
本试剂盒可以检测细胞或组织匀浆液上清、全血、红细胞抽提物、血清等生物样品中的超氧化物歧化酶(Superoxide Dismutase,SOD)活性。基于WST-8的显色反应,通过比色法检测SOD活性。
目前有多种SOD活性测定法,其中NBT(氮蓝四唑)法由于使用方便而被广泛使用。但NBT法产生的甲臜染料水溶性差,易和被还原的黄嘌呤氧化酶相互作用,抑制百分率达不到100%等,从而使检测的灵敏度和精确度受到影响;细胞色素C法也是一种常用来检测SOD活性的方法,但细胞色素C其氧化活性高,易受样品中的还原剂干扰,另外该方法需要连续测定吸光度值,对于SOD的检测灵敏度比较低,并且不太适合大批量样本的检测。
目前测定SOD比较先进的方法包括WST-1法和WST-8法,其中WST-8法比WST-1法更加稳定、灵敏度更高。本试剂盒采用了目前测定SOD方法中稳定性更好、灵敏度更高的WST-8法,可以检测出低达0.5U/ml的超氧化物歧化酶。WST-8法的原理参考图1,WST-8可以和黄嘌呤氧化酶(Xanthine Oxidase,XO)催化产生的超氧化物阴离子(O2·-)反应产生水溶性的甲臜染料(formazan dye),由于SOD能催化超氧化物阴离子发生歧化作用,所以该反应步骤可以被SOD所抑制,因此SOD的活性与甲臜染料的生成量成负相关,从而通过对WST-8产物的比色分析即可计算SOD的酶活力。

图1.基于黄嘌呤氧化酶偶联反应体系和WST-8的SOD酶活力检测原理图。XO:xanthine oxidase。
WST-8的反应产物是稳定的水溶性产物,可以通过单个时间点的吸光度检测来测定SOD活力,适合高通量筛选研究。同时WST-8法测定SOD酶活力时,最大抑制百分率可以接近100%,并且可以不受一些常见的干扰因素的干扰,使检测效果比其它的一些常见方法显著改善。
本试剂盒的性能优于同类产品总SOD活性检测试剂盒(NBT法)。本产品的用途与同类产品总SOD活性检测试剂盒(NBT法)相同,等量SOD导致的吸光度变化值显著大于NBT法,线性范围更宽。本试剂盒提供的SOD样品制备液能直接裂解细胞,无需匀浆,操作更加便捷。
本试剂盒的检测不受样品中过氧化氢的干扰。很多细胞和组织样品中含有内源性的过氧化氢,会干扰SOD的检测。本试剂盒通过添加适量过氧化氢酶等特殊方法,能有效去除常规样品中过氧化氢的干扰。例如,对于SOD标准品的检测,标准品中添加高达0.1mM的过氧化氢时,对于检测结果仍无显著影响。

| 规格 | 100T | 250T |
| SOD样品制备液 | 50mL | 125mL |
| SOD检测缓冲液 | 50mL | 125mL |
| WST-8 | 800μL | 2mL |
| 酶溶液 | 100μL | 250μL |
| 反应启动液(40X) | 60μL | 150μL |
| 说明书 | 1份 | 1份 |
保存:-20℃,有效期6个月,WST-8需避光保存。

- 待测样品-70℃可保存1个月。需注意反复冻融会导致SOD部分失活。
- 一个试剂盒如果不能在3次内使用完毕,其中的WST-8需要在首次使用时适当分装,以避免反复冻融导致的检测效果下降。
- 标准品稀释时所用的稀释液应尽量与样品一致。样品用试剂盒提供的SOD样品制备液制备时,标准品也宜使用SOD样品制备液进行稀释;当样品为血液等无需处理的样品时,宜使用试剂盒提供的SOD检测缓冲液稀释标准品。
- 抗氧化物会对本试剂盒的检测产生干扰,例如0.1mM ascorbic acid,5mM GSH都会使测定出来的吸光度显著升高。此时尽管样品没有颜色,如果设置了使用说明中的空白对照3,就可以消除样品中的抗氧化物的干扰。

- 样品的准备:
- 细胞样品的准备:对于贴壁细胞,吸净细胞培养液,用4℃或冰浴预冷的PBS或生理盐水洗涤一遍,按照每100万细胞加入100~200μL的比例加入本试剂盒提供的SOD样品制备液,适当吹打以充分裂解细胞;对于悬浮细胞,600g离心5分钟收集细胞,用4℃或冰浴预冷的PBS或生理盐水洗涤一遍,按照每100万细胞加入100~200μL的比例加入SOD样品制备液,适当吹打,以充分裂解细胞。4℃约12000g离心3~5分钟,取上清作为待测样品。
- 组织样品的准备:动物用生理盐水(0.9% NaCl,含有0.16mg/ml肝素钠)灌流清除血液后获取组织样品。取适量的组织样品,按照每10mg组织加入100μL SOD样品制备液的比例在4℃或冰浴进行匀浆(可以使用玻璃匀浆器或各类常见电动匀浆器)。4℃约12000g离心3~5分钟,取上清作为待测样品。
- 血浆或红细胞样品的准备:用抗凝管收集血液,颠倒混匀。4℃ 600g离心10分钟,移取上清至另一新的1mL离心管中,适量生理盐水稀释后即可作为血浆样本进行检测。红细胞样品可以参考步骤1a悬浮细胞样品的制备方法,或其它不含Triton X-100等去垢剂的样品制备方法。
- 上述样品准备完毕后可以用百奥莱博生产的BCA蛋白浓度测定试剂盒(货号:YT036/YT037)测定蛋白浓度。通常10~20μg蛋白的细胞或组织匀浆液样品中的SOD平均活力约1个活力单位左右(不同细胞和组织的差异会比较大,该活力范围仅作为初步的参考)。每种样品准备20~100μg蛋白量通常已经足够用于后续检测。
- 根据蛋白浓度和预计的蛋白使用量,用本试剂盒提供的SOD检测缓冲液适当稀释样品。例如,小鼠肝脏组织10%匀浆液(组织和匀浆液的重量比为1:10)上清,通常需要稀释10~100倍。准备好的样品如果当天测定,可以冰浴保存;如果当天不能完成测定,可以-70℃冻存,但建议尽量当天完成测定。
- 细胞样品的准备:对于贴壁细胞,吸净细胞培养液,用4℃或冰浴预冷的PBS或生理盐水洗涤一遍,按照每100万细胞加入100~200μL的比例加入本试剂盒提供的SOD样品制备液,适当吹打以充分裂解细胞;对于悬浮细胞,600g离心5分钟收集细胞,用4℃或冰浴预冷的PBS或生理盐水洗涤一遍,按照每100万细胞加入100~200μL的比例加入SOD样品制备液,适当吹打,以充分裂解细胞。4℃约12000g离心3~5分钟,取上清作为待测样品。
- 试剂盒的准备工作:
- WST-8/酶工作液的配制:按照每个反应160μL的体积配制适量的WST-8/酶工作液。均匀混合151μL SOD检测缓冲液、8μL WST-8和1μL酶溶液,即可配制成160μL WST-8/酶工作液。根据待检测样品(包括标准品)的数量,配制适量的WST-8/酶工作液。具体配制方法可以参考下表。配制好的WST-8/酶工作液4℃或冰浴保存,可以在当天使用,但建议尽量现配现用。
注意:由于酶溶液的用量较少且易沉降,必须注意在使用前先轻轻离心一下,然后适当混匀后再使用。待测样品数量 1 10 20 50 SOD检测缓冲液(μl) 151 1510 3020 7550 WST-8(μl) 8 80 160 400 酶溶液(μl) 1 10 20 50 WST-8/酶工作液(μl) 160 1600 3200 8000 - 反应启动工作液的配制:把试剂盒中的反应启动液(40X)融解后混匀,按照每1μL反应启动液(40X)加入39μL SOD检测缓冲液的比例进行稀释,混匀后即为反应启动工作液。根据待检测样品(包括标准品)的数量,配制适量的反应启动工作液。配制好的反应启动工作液4℃或冰浴保存,可以在当天使用,但建议尽量现配现用。
- (可选做)SOD标准品准备:需自备SOD标准品,用本试剂盒提供的SOD样品制备液(当样品用试剂盒提供的SOD样品制备液制备时)或SOD检测缓冲液(当样品为血液等无需处理的样品时)将SOD标准品稀释至如下系列浓度:100U/ml,50U/ml,20U/ml,10U/ml,5U/ml,2U/ml,1U/ml。在随后的检测中可以各取20μL,参考样品进行检测。SOD标准品的检测效果参考图2。说明:为避免稀释后SOD酶活性的下降,SOD标准品宜现稀释现使用;本试剂盒对于SOD的检测并不需要SOD作为标准品,但可以使用SOD标准品作为阳性对照或作为对SOD活性定量的参考。
- WST-8/酶工作液的配制:按照每个反应160μL的体积配制适量的WST-8/酶工作液。均匀混合151μL SOD检测缓冲液、8μL WST-8和1μL酶溶液,即可配制成160μL WST-8/酶工作液。根据待检测样品(包括标准品)的数量,配制适量的WST-8/酶工作液。具体配制方法可以参考下表。配制好的WST-8/酶工作液4℃或冰浴保存,可以在当天使用,但建议尽量现配现用。
- 样品测定:
- 参考下表使用96孔板设置样品孔和各种空白对照孔。并按下表依次加入待测样品和其它各种溶液。加入反应启动工作液后充分混匀。
注意:加入反应启动工作液后反应即会开始,可以在低温操作或用排枪操作以减小各孔间因加入反应启动工作液的时间先后差异而导致的误差。样品(Sample)/标准品 空白对照1(Blank1) 空白对照2(Blank2) 空白对照3 (Blank3)* 待测样品 20μL - - 20μL SOD检测缓冲液 - 20μL 40μL 20μL WST-8/酶工作液 160μL 160μL 160μL 160μL 反应启动工作液 20μL 20μL - -
注*:如果样品有颜色或含有抗氧化物质,则需设置空白对照3;如果样品没有颜色并且也不含有抗氧化物则没有必要设置空白对照3。 - 37℃孵育30分钟。
说明:孵育25至35分钟检测出来的SOD活力无显著差异,但为保证检测结果的一致性,推荐孵育30分钟。 - 在450nm测定吸光度。如无450nm滤光片,可以使用420~480nm的滤光片。可以选择设定600nm (或600nm以上,如650nm)作为参比波长(也称参考波长),450nm吸光度的读数扣除参比波长的吸光度读数即可作为实测读数。
- 参考下表使用96孔板设置样品孔和各种空白对照孔。并按下表依次加入待测样品和其它各种溶液。加入反应启动工作液后充分混匀。
- 样品中总SOD活力的计算:
- 抑制百分率的计算:
参考如下计算公式计算抑制百分率:
抑制百分率=[(A空白对照1-A空白对照2)-(A样品-A空白对照3)]/(A空白对照1-A空白对照2)×100%
如果样品没有颜色并且也不含有抗氧化物,则A空白对照2 = A空白对照3,此时可以把计算公式简化为如下形式(简化时可以不设置空白对照3):
抑制百分率= (A空白对照1-A样品)/(A空白对照1-A空白对照2)×100%
如果计算出来的抑制百分率小于30%或大于70%,则通常需要把该样品重新测定。尽量使样品的抑制百分率在30~70%范围内。如果测定出来的抑制百分率偏高,则需适当稀释样品;如果测定出来的抑制百分率偏低,则需重新准备浓度较高的待测样品。 - SOD酶活力单位的定义:在上述黄嘌呤氧化酶偶联反应体系中抑制百分率为50%时,反应体系中的SOD酶活力定义为一个酶活力单位(unit)。
注意:SOD的活力单位的定义方式有很多种,不同的活力单位需根据其定义的不同进行适当换算。 - SOD酶活力的计算:
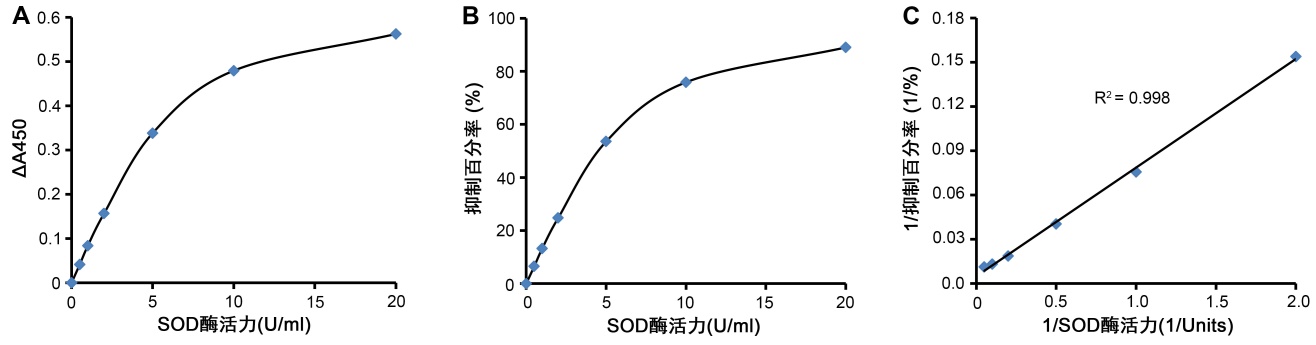
图2.本试剂盒对SOD标准品的检测效果。图A纵坐标ΔA450为孵育30分钟后,空白对照1与SOD标准品孔的吸光度差值。SOD酶活力和ΔA450及抑制百分率(图B)呈非线性关系,而1/SOD酶活力和1/抑制百分率成线性关系(图C)。图中数据仅作参考,实际测定获得的标准曲线的斜率和截距可能会因具体反应条件的不同和上图有较明显的差别。
SOD酶活力的计算公式如下:
待测样品中SOD酶活力单位=检测体系中SOD酶活力单位=抑制百分率/(1-抑制百分率)units
例如,当抑制百分率为50%时,待测样品中SOD酶活力单位=50%/(1~50%)units=1 unit;当抑制百分率为60%时,待测样品中SOD酶活力单位=60%/(1~60%)units=1.5 units。 - 如果样品为细胞或组织的匀浆液,可以根据样品的蛋白浓度和稀释倍数,将SOD活力单位换算为U/g或U/mg蛋白。如果样品为红细胞抽提液,可以根据血红蛋白含量,可换算为U/克血红蛋白或U/mg血红蛋白。
附1:SOD酶活力计算的参考方案:可以先使用本试剂盒绘制SOD标准品的抑制百分率曲线,然后根据样品检测到的抑制百分率对比标准品的抑制百分率曲线计算出样品中的SOD酶活力单位。本方案仅供参考,使用本试剂盒时不必使用本方案进行检测和计算。此外,本方案需确保标准品的酶活力数据可靠,不会因为标准品的保存问题而导致实际酶活力下降。
附2:SOD酶活力的动力学检测:如果条件许可,使用本试剂盒时也可以使用动力学方法检测SOD的酶活力。通常在步骤3a后可以37℃孵育同时在450nm连续测定吸光度30分钟。根据30分钟内的吸光度变化的斜率计算出抑制百分率:
抑制百分率=[(斜率空白对照1-斜率空白对照2)-(斜率样品-斜率空白对照3)]/(斜率空白对照1-斜率空白对照2)×100%
其余的计算方法同上述非动力学的计算方法。动力学方法的检测和计算更加精确一些,但检测起来相对要麻烦一些。使用本试剂盒通常使用非动力学方法即可。
- 抑制百分率的计算:
相关搜索:总SOD活性检测试剂盒(WST-8法),总SOD活性检测试剂盒,WST-8法总SOD活性检测试剂盒,总SOD活性检测试剂盒,WST-8法总SOD检测试剂盒,WST-8法SOD检测试剂盒,总SOD检测试剂盒,总SOD检测试剂盒,超氧化物歧化酶活性检测试剂盒,超氧化物歧化酶检测试剂盒,Total Superoxide Dismutase Assay Kit with WST-8



